Астения, причины и лечение астенического синдрома
Опыт лечения больных с синдромом Пламмера—Винсона
Обмен опытом Experience exchange
Доказательная гастроэнтерология 2019, Т. 8, No3, с. 71-76
Russian journal of evidence-based Gastroenterology 2019, vol. 8, No3, pp. 71-76
Опыт лечения больных с синдромом Пламмера—Винсона
© Ф.П. ВЕТШЕВ, С.В. ОСМИНИН, С.П. ВЕТШЕВ, А.П. ДЕРГУНОВА
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» (Сеченовский Университет) Минздрава России, Москва, Россия
РЕЗЮМЕ
Цель исследования — обобщить опыт комплексного подхода к лечению больных синдромом Пламмера—Винсона.
Материал и методы. В период с 2010 по 2019 г. в Клинике факультетской хирургии им. Н.Н. Бурденко ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет) проходили лечение 7 женщин с синдромом Пламмера—Винсона. Все пациентки были европеоидной расы, средний возраст составлял 41±4,5 года (29—56 лет). Анамнез заболевания от 7 до 11 лет. Дисфагию I степени наблюдали у 2 (28,6%) и дис- фагию II—III степени — у 5 (71,4%) человек. Диаметр области сужения в среднем составлял 5,9±2,1 (4—8) мм. У 4 (57,2%) женщин выявили аутоиммунный тиреоидит. Уровень гемоглобина крови при поступлении от 42 до 106 г/л. Всем проводили коррекцию уровня гемоглобина крови и курс баллонной дилатации стриктуры пищевода.
Результаты. У всех пациенток в результате лечения достигли уровня гемоглобина крови от 113 г/л и выше. Проводили сеансы баллонной дилатации: 2 пациенткам провели 1 сеанс, 4 (57,2%) — 3 сеанса и еще в 1 наблюдении потребовалось 4 процедуры для получения адекватного лечебного эффекта. Осложнений лечения не наблюдали. Улучшение прохождения пищи отмечали после первого сеанса дилатации стриктуры.
Выводы. Описанная серия наблюдений позволяет сделать вывод о том, что диагностика синдрома Пламмера—Винсона не вызывает затруднений, если врач обладает сведениями о заболевании. Больные синдромом Пламмера—Винсона хорошо поддаются лечению, что подтверждает международный и собственный опыт, однако нуждаются в динамическом наблюдении.
Ключевые слова: синдром Пламмера—Винсона, дисфагия, стриктура пищевода, баллонная дилатация.
ИНФОРМАЦИЯ ОБ АВТОРАХ: Ветшев Ф.П. — д.м.н., проф; e-mail: fedor_vethev@mail.ru Осминин С.В. — к.м.н.; Ветшев С.П. — к.м.н., доц.; Дергунова А.П. — Автор, ответственный за переписку: Ветшев Ф.П. — e-mail: fedor_vethev@mail.ru
КАК ЦИТИРОВАТЬ: Ветшев Ф.П., Осминин С.В., Ветшев С.П., Дергунова А.П. Опыт лечения больных с синдромом Пламмера—Винсона. Доказательная гастроэнтерология. 2019;8(3):71-76.
An experience of Plummer—Vinson syndrome management
© F.P. VETSHEV, S.V. OSMININ, S.P. VETSHEV, A.P. DERGUNOVA
Sechenov First Moscow State Medical University of the Ministry of Health of the Russia, Moscow, Russia
ABSTRACT Objective — to summarize the experience of the complex treatment of patients with Plummer—Vinson syndrome (PVS). Material and methods. There were 7 women with PVS who were treated in the Clinic of Faculty-Based Surgery of the Sechenov First Moscow State Medical University in 2010—2019. All patients were Caucasian females aged 41±4.5 years (range 29—56 years). Anamnesis of disease was from 7 to 11 years. Dysphagia grade I was noted in 2 (28.6%) cases, grade II—III — in 5 (71.4%) patients. Mean diameter of the narrowed area was 5.9±2.1 mm (range 4—8 mm). Autoimmune thyroiditis was diagnosed in 4 (57.2%) women. Hemoglobin levels ranged from 42 to 106 g/l at admission. All patients underwent anemia correction and a course of balloon dilation of the esophageal stricture. Results. Treatment resulted in augmentation of hemoglobin level over 113 g/l in all patients. One course of balloon dilation for adequate effect was required in 2 (28.6%) patients, 3 courses — in 4 (57.2%) women, 4 courses — in 1 patient. There were no complications of treatment. Improved food passage was noted after the first course of stricture dilation. Conclusion. Diagnosis of PVS does not cause any serious difficulties if a physician is informed about this disease. PVS patients respond well to the treatment that is confirmed by international and own experience. However, a dynamic followup is required.
Keywords: Plummer—Vinson syndrome, dysphagia, esophageal stricture, balloon dilation.
INFORMATION ABOUT THE AUTHORS: Vetshev F.P. — e-mail: fedor_vethev@mail.ru Osminin S.V. — Vetshev S.P. — Dergunova A.P. — Corresponding author: Vetshev F.P. — e-mail: fedor_vethev@mail.ru
TO CITE THIS ARTICLE: Vetshev FP, Osminin SV, Vetshev SP, Dergunova AP. An experience of Plummer—Vinson syndrome management. Russian Journal of Evidence- based Gastroenterology = Dokazatel’naya gastroenterologiya. 2019;8(3):71-76. (In Russ.).
Синдром Пламмера—Винсона является редким заболеванием и характеризуется классической триадой симптомов — дисфагией, железодефицитной анемией и стриктурой пищевода. Несмотря на то что синдром впервые описан еще в 1912 г., причина его возникновения до конца не изучена, а работ, посвященных этой проблеме, крайне мало. Известно также, что заболевание сопряжено с риском развития рака глотки и шейного отдела пищевода.
В литературе можно найти несколько названий этого синдрома. Наиболее распространенное — в честь физиологов Генри Стенли Пламмера (Henry Stanley Plummer, 1874—1936) и Портера Пейзли Винсона (Porter Paisley Vinson, 1890—1959), которые, работая в клинике Мейо, впервые описали его в 1912 и 1919 г. соответственно. Заболевание также известно как синдром Патерсона—Брауна—Келли и сидеропеническая дисфагия. Британские ларингологи Дональд Росс Патерсон (Donald Ross Paterson, 1863—1939) и Адам Браун-Келли (Adam Brown-Kelly, 1865—1941) в 1919 г. независимо друг от друга опубликовали характерные клинические признаки этого синдрома.
Данные о распространенности заболеваемости до настоящего времени точно не определены. В последнее время в литературе можно найти лишь отдельные описания клинических наблюдений. Так, в одном популяционном исследовании, проведенном еще в 60-х годах прошлого века в Южном Уэльсе, оценивали распространенность посткрикоидных стриктур пищевода. В общей популяции среди женщин распространенность составила от 0,3 до 1,1%, а у женщин с дисфагией — от 8,4 до 22,4%. У мужчин ни в одном из опубликованных наблюдений посткрикоидные стриктуры пищевода не выявлены[1].
В первой половине XX века считалось, что развитие заболевания более характерно для людей белой расы из северных стран, при этом до 90% больных — это женщины, преимущественно в возрасте от 40 до 70 лет[2].Сегодня пациентов с подобным заболеванием можно встретить крайне редко. Например, из 1000 пациентов, которым выполнили кинерадиографическое исследование глотки и шейного отдела пищевода, стриктуры обнаружены у 5,5% больных, но только у 6 из них наблюдалась дисфагия, и ни один из этих случаев в полной мере не отвечал известным критериям синдрома Пламмера—Винсона[3, 4]. Приводимые в некоторых работах данные о снижении заболеваемости многие связывают с улучшением питания и коррекцией железодефицитной анемии в странах, где ранее часто выявляли синдром Пламмера—Винсона[5]. Даже в Африке, где алиментарная железодефицитная анемия и недоедание являются распространенным явлением, это заболевание встречается крайне редко.
Синдром Пламмера—Винсона рассматривают как фактор риска развития плоскоклеточного рака гортаноглотки, шейного отдела пищевода и желудка[4, 6]. Мембранозные (пленчатые) стриктуры пищевода представляют собой тонкие складки слизистой оболочки с некоторыми изменениями, распространяющимися до слизистой оболочки полости рта. Эти изменения заключаются в атрофии эпителия или гиперкератозе и могут быть причиной высокой заболеваемости (более 16%) злокачественными опухолями дыхательной и пищеварительной систем. Известно, что у 3—15% женщин с синдромом Пламмера—Винсона в возрасте от 15 до 50 лет развивается рак глотки или пищевода[6].
Уменьшение частоты рака этой локализации у женщин может быть обусловлено снижением распространенности этого заболевания[4, 6]. В настоящее время существует ряд версий о патогенезе этой болезни. Традиционно считается, что основную роль в развитии заболевания играет дефицит железа, недостаток которого приводит к снижению активности железозависимых окислительных ферментов, которые в свою очередь могут индуцировать миастенические процессы в мышцах и атрофию слизистой оболочки пищевода с последующим формированием стриктуры[5].
Эта теория статистически значимо подтверждена данными лабораторных исследований, в которых у мышей с железодефицитной анемией наблюдали разрушение митохондрий клеток глоточных мышц, аналогичное прогрессирующей мышечной дистрофии [7, 8]. Повреждения митохондрий также способствуют нейродегенерации и старению слизистой оболочки. Дополнительным доказательством железодефицитной теории патогенеза является регрессия дисфагии на фоне приема препаратов железа. К другим причинам развития синдрома традиционно относят недостаток витаминов, аутоиммунные факторы и генетическую предрасположенность.
Синдром Пламмера—Винсона довольно часто сочетается с аутоиммунными заболеваниями, такими как целиакия, аутоиммунный тиреоидит, ревматоидный артрит, что мы наблюдали и у наших больных [4, 9, 10].
Основными клиническими проявлениями синдрома считают посткрикоидную дисфагию, мембранозные («пленочные») стриктуры верхних отделов пищевода и железодефицитную анемию [9]. Дисфагия, как правило, безболезненная, временная или прогрессирующая в течение нескольких лет, что является ограничивающим фактором в приеме твердой пищи и приводит к снижению массы тела. В клинической картине могут доминировать симптомы, характерные для анемии, — слабость, бледность, усталость и тахикардия. Среди симптомов могут присутствовать глоссит, угловой хейлит и койлонихия (ложкообразные ногти). Спленомегалия и увеличение щитовидной железы также могут быть проявлениями, характерными для синдрома Пламмера—Винсона [11].
Диагноз устанавливают, исходя из лабораторных показателей, доказанной железодефицитной анемии (уровень гемоглобина, гематокритное число, средний объем эритроцита, уровень железа сыворотки, ферритина, трансферрина, повышение железосвязываюшей способности сыворотки крови) и наличия посткрикоидной дисфагии, обусловленной одной стриктурой пищевода или более. Стриктуры могут быть выявлены при рентгенографии, а также при эзофагогастродуоденоскопии (ЭГДС) [11]. Как правило, при ЭГДС определяются стриктуры гладкие, тонкие, серые с эксцентричным или центральным входом, они типично расположены в проксимальных отделах пищевода и могут быть пропущены и случайно разорваны, если эндоскоп не введен под достаточным контролем при прямой визуализации [11].
Поскольку дисфагия является основным клиническим признаком синдрома Пламмера—Винсона, дифференциальная диагностика должна быть направлена на исключение других заболеваний, вызывающих дисфагию. В перечень дифференциальнодиагностического поиска необходимо включать рак пищевода, дивертикулы пищевода, нервномышечные заболевания пищевода (ахалазия, кардиоспазм, диффузный эзофагоспазм), склеродермию, пептические и ожоговые стриктуры, грыжу пищеводного отверстия диафрагмы, сдавливающие пищевод образования средостения.
Наиболее простыми и эффективными способами лечения заболевания являются восполнение дефицита железа и дилатация стриктуры пищевода. Как правило, прием препаратов железа купирует основные клинические проявления синдрома [12].
Однако при выраженной дисфагии, обусловленной значительным сужением в области стриктуры пищевода, необходимо прибегать к механическому расширению бужированием или дилатации. Согласно данным литературы [12, 13], одного сеанса дилатации бывает достаточно для ликвидации дисфагии, однако рекомендуется проведение нескольких сеансов во избежание быстрого рецидива стриктуры. Рецидив заболевания при комбинированном лечении (дилатация стриктуры и коррекция анемии) в раннем периоде не превышает 10%, а в отдаленном достигает 20— 30% наблюдений.
Цель исследования — обобщить опыт комплексного подхода к лечению больных синдромом Пламмера—Винсона.
Материал и методы
В период с 2010 по 2019 г. в Клинике факультетской хирургии им. Н.Н. Бурденко ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» (Сеченовский Университет) Минздрава России проходили лечение 7 женщин с синдромом Пламмера—Винсона. Основные характеристики и клинические симптомы пациенток собраны и проанализированы ретроспективно на основании электронной базы данных клиники (см. таблицу).
Все пациентки были европеоидной расы, средний возраст составлял 41±4,5 года (от 29 до 56 лет). У всех женщин отмечен длительный анамнез заболевания — от 7 до 11 лет. Характерные для стриктуры пищевода жалобы на затруднение прохождения пищи по пищеводу предъявляли все больные: дисфагию I степени наблюдали у 2 (28,6%) и дисфагию II— III степени — у 5 (71,4%) человек. Жалобы на общую слабость, недомогание и головокружение, присущие железодефицитной анемии, также описаны всеми пациентками.
План обследования включал проведение ЭГДС, рентгенографию пищевода, желудка и двенадцатиперстной кишки с сульфатом бария, а также стандартный набор лабораторных анализов крови и мочи.
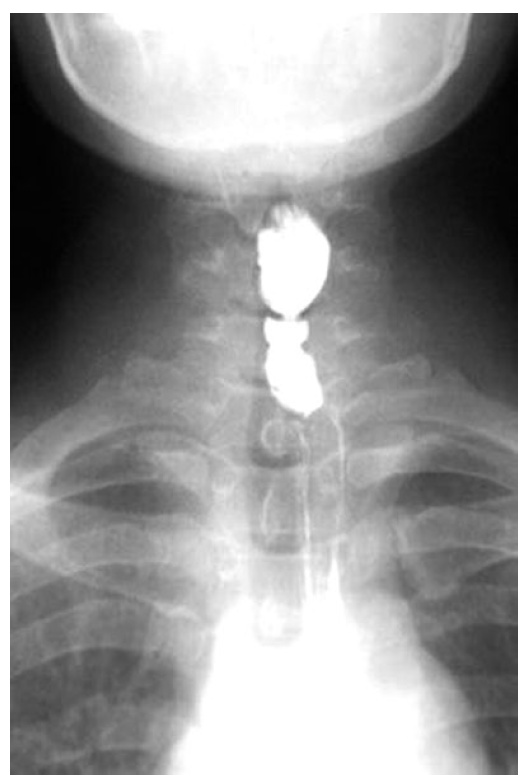
По результатам эндоскопического исследования, диаметр просвета пищевода в области сужения в среднем составлял 5,9±2,1 (4—8) мм и у 2 пациенток был непроходим для детского эндоскопа (рис. 1). По данным лучевых методов диагностики, протяженность зоны стеноза шейного отдела пищевода не превышала 1 см (рис. 2, 3). У всех больных при ЭГДС выявлены признаки эзофагита различной степени тяжести. У 4 женщин выявлен аутоиммунный тиреоидит, других сопутствующих заболеваний в группе наблюдения не было.
В общем анализе крови у всех обнаружили гипохромную железодефицитную анемию различной степени тяжести с уровнем гемоглобина при поступлении в стационар от 42 до 106 г/л.
Основные клинические характеристики больных (n=7) Major clinical characteristics of patients (n=7)
Возраст, годы 41,1 (29—56)
Пол, мужчины/женщины, абс. (%) 0 /7 (100)
Анамнез заболевания, годы 9,1 (7—11)
Степень стеноза пищевода*, абс. (%)
II (6—8 мм) 4 (57,2)
III (3—5 мм) 3 (42,8)
Сопутствующие заболевания
аутоиммунный тиреодит, абс. (%) 2 (28,6)
Степень анемии (гемоглобин крови, г/л), абс. (%)
средняя (89—70) 3 (42,8)
тяжелая (менее 70) 4 (57,2)
Симптомы, абс. (%)
изжога 4 (57,2)
дисфагия, I степень 2 (28,6)
дисфагия, II—III степень 5 (71,4)
Степень тяжести рефлюкс-эзофагита**, абс. (%)
рефлюкс-эзофагит легкой степени тяжести 1 (14,3)
рефлюкс-эзофагит средней степени тяжести 5 (71,4)
эрозивный рефлюкс-эзофагит 1 (14,3)
Примечание. * — степень стеноза пищевода приведена по классификации Ю.И. Галлингера (1999) [14]; ** — степень тяжести рефлюкс-эзофагита приведена по классификации А.Ф. Черноусова (1973) [15].
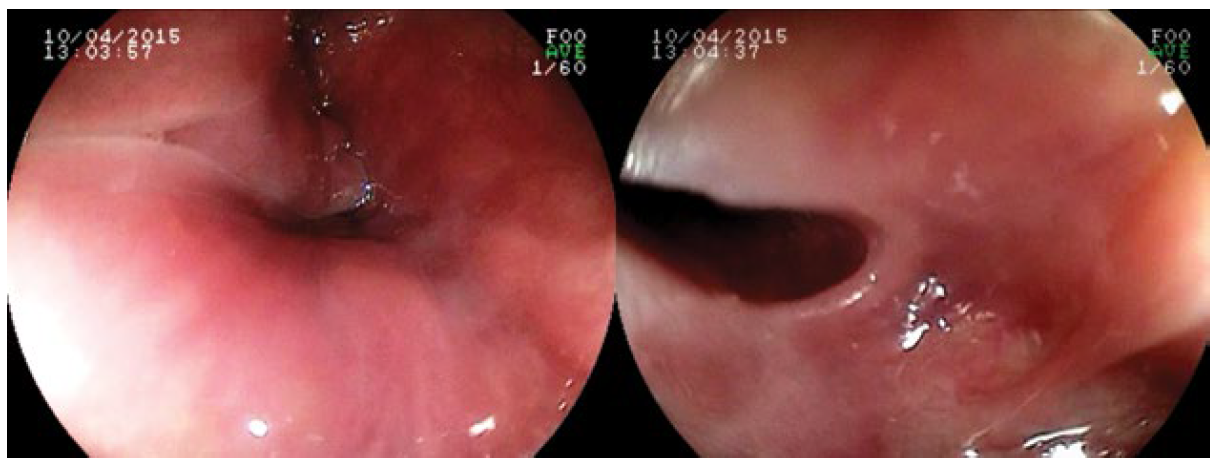
Рис. 1. Эндоскопическая фотография мембранозной стриктуры шейного отдела пищевода. Fig. 1. Endoscopic image of membranous stricture of the cervical esophagus.
После консультации гематологом всем проводили коррекцию уровня гемоглобина крови путем перорального приема или инфузионного введения препаратов железа, а также курс баллонной дилатации стриктуры шейного отдела пищевода под контролем рентгеноскопии.
Сеансы баллонной дилатации проводили под рентгенологическим контролем стриктурным баллоном QD-20×80 («Willson—Cook Medical Inc.», США). Баллон устанавливали в области стриктуры шейного отдела пищевода и выполняли однократную дилатацию до полного расправления баллона (20 мм) с экспозицией 30 с (максимальное давление 1,1 атм) при помощи инсуффлятора с манометром («Willson—Cook Medical Inc.», США). По окончании процедуры баллон удаляли и выполняли контрольную рентгеноскопию с водорастворимым контрастным веществом. Курс лечения включал от 1 до 4 сеансов баллонной дилатации в зависимости от полученного эффекта, который оценивали на основании клинических и рентгенологических признаков регрессии дисфагии. Промежуток между сеансами составлял от 3 до 7 дней.
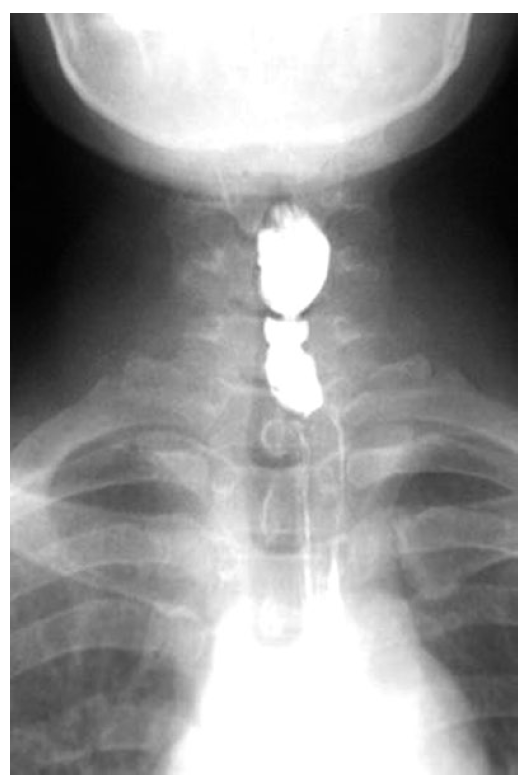
Рис. 2. Рентгенограмма. Короткая мембранозная стриктура шейного отдела пищевода. Fig. 2. X-ray scan. Short membranous stricture of the cervical esophagus.
Результаты
У всех пациенток после инфузионной коррекции анемии удалось достичь целевых показателей уровня гемоглобина крови от 113 г/л и выше. В 4 (57,2%) наблюдениях женщинам с уровнем гемоглобина крови менее 65 г/л при поступлении в стационар провели несколько трансфузий эритроцитарной массы.
Количество проведенных сеансов дилатации варьировало в зависимости от характеристик расправления баллона во время первой процедуры и клинического эффекта: 2 (28,6%) пациенткам провели 1 сеанс, 4 (57,2%) — 3 сеанса и еще в 1 наблюдении потребовалось 4 процедуры для получения адекватного лечебного эффекта. Во время проведения процедур каких-либо осложнений ни у одной пациентки не возникло.
Во всех наблюдениях больные отмечали улучшение прохождения пищи уже после первого сеанса дилатации стриктуры. При этом жалобы на болезненность во время процедуры и в течение 1 сут после нее были лишь у 2 женщин.
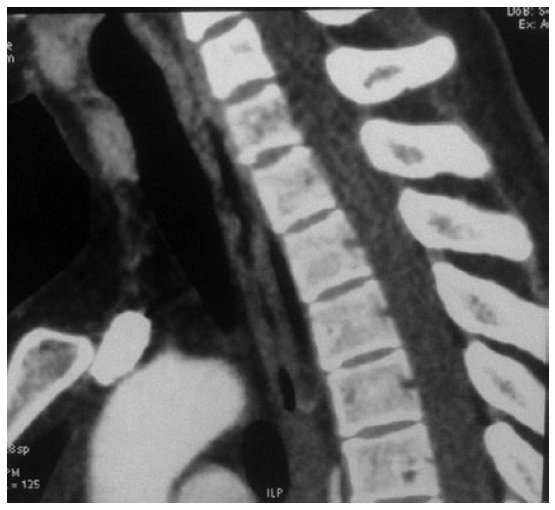
Рис. 3. Мультиспиральная компьютерная томограмма. Мембранозная стриктура шейного отдела пищевода. Fig. 3. CT-scan. Membranous stricture of the cervical esophagus.
На фоне комплексного лечения в раннем периоде у всех больных регрессировала дисфагия. При рентгенографии и ЭГДС признаков сужения пищевода не выявлено (рис. 4). В отдаленном периоде 4 пациенткам потребовалась систематическая коррекция уровня гемоглобина и железа пероральными препаратами железа. У 2 больных через 6 и 11 мес наблюдали рецидив дисфагии и стриктуры шейного отдела на фоне снижения уровня гемоглобина крови до 70—80 г/л, что явилось показанием к выполнению поддерживающих сеансов баллонной дилатации пищевода. К сожалению, у одной из этих больных уровень железа крови и гемоглобина удается поддерживать исключительно медикаментозно, а возникающая с регулярной периодичностью стриктура на фоне хронической железодефицитной анемии требует систематических сеансов (1—2 раза в 5—7 мес) дилатации.
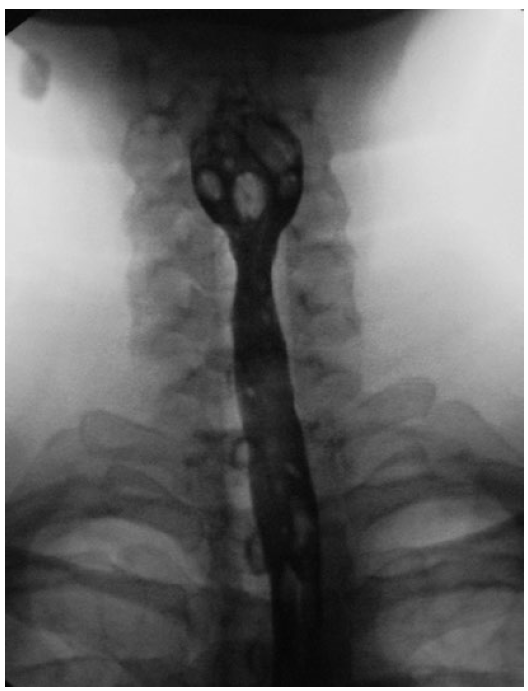
Рис. 4. Рентгенограмма. Шейный отдел пищевода после проведения сеансов баллонной дилатации стриктуры. Fig. 4. X-ray scan. Cervical esophagus after balloon dilatation of the stricture.
Заключение
Описанная серия наблюдений позволяет сделать вывод о том, что диагностика синдрома Пламмера— Винсона не вызывает серьезных затруднений, если врач обладает элементарными сведениями о заболевании, фактически осведомлен о триаде симптомов. В то же время лечение этой категории больных целесообразно проводить в стационарах, оснащен ных всем арсеналом современных диагностических и лечебных технологий и обеспеченных персоналом, обладающим достаточным опытом.
Крайне важно провести дифференциальную диагностику и исключить другие заболевания, проявлениями которых может быть дисфагия. Следует также помнить, что целиакия, гигантская грыжа пищеводного отверстия диафрагмы, рак желудка, синдром Шегрена и пернициозная анемия могут стать причиной синдрома Пламмера—Винсона.
В целом больные с этим заболеванием хорошо поддаются лечению, что под- тверждает международный и собственный опыт, од- нако нуждаются в динамическом наблюдении в те- чение многих лет.
Авторы заявляют об отсутствии конфликта интересов. The authors declare no conflict of interest.
ЛИТЕРАТУРА/REFERENCES
1. Elwood PC, Jacobs A, Pitman RG, Entwistle CC. Epidemiology
of the Paterson—Kelly syndrome. Lancet. 1964;2(7362):716-720.
2. Lopez A, Cacoub P, MacDougall IC, Peyrin-Biroulet L. Iron de- ficiency anaemia. Lancet. 2016;387(10021):907-916..
3. Nosher JL, Campbel WL, Seaman WB. The clinical significance of cervical esophageal and hypopharyngeal webs. Radiology. 1975;117:45-47.
4. Черноусов А.Ф., Ветшев Ф.П., Хоробрых Т.В., Роголь М.М. Синдром Пламмера—Винсона. Хирургия. 2013;10:46-49. Chernousov AF, Vetshev FP, Khorobrykh TV, Rogol MM. Plam- mer—Vinson syndrome. Hirurgiya. 2013;10:46-49. (In Russ.).
5. Chen TS, Chen PS. Rise and fall of the Plummer—Vinson syn- drome. Journal of Gastroenterology and Hepatology. 1994;9:654-658.
6. Rashid Z, Kumar A, Komar M. Plummer—Vinson syndrome and postcricoid carcinoma: late complications of unrecognized celiac disease. American Journal of Gastroenterology. 1999;94(7):1991.1572-0241.1999.01653.x
7. Chisholm M. The association between webs, iron and post-cricoid carcinoma. Postgraduate Medical Journal. 1974;50(582):215-219.
8. Dantas RO, Villanova MG. Esophageal motility impairment in Plummer—Vinson syndrome. Digestive Diseases and Sciences. 1993;38(5):968-971.
9. Goel A, Bakshi SS, Soni N, Chhavi N. Iron deficiency anemia and Plummer—Vinson syndrome: current insights. Journal of Blood Medicine. 2017;8:175.
10. Lo KB, Albano J, Sandhu N, Candelario N. Plummer—Vinson syndrome: improving outcomes with a multidisciplinary approach. Journal of Multidisciplinary Healthcare. 2019;12:471-477.
11. Hoffmann RM, Jaffe PE. Plummer—Vinson syndrome. A case re- port and literature review. Archives of Internal Medicine. 1995;155:2008- 2111.
12. Bakari G, Benelbarhdadi I, Bahije L, El feydi Essaid A. Endoscop- ic treatment of 135 cases of Plummer—Vinson web: a pilot experi- ence. Gastrointestinal Endoscopy. 2014;80(4):738-741.
13. Demirci F, Savas MC, Kepkep N, Okan V, Yilmaz M, Büyükber- ber M, Gülsen MT. Plummer—Vinson syndrome and dilation ther- apy: a report of two cases. Turkish Journal of Gastroenterology. 2005;16:224-227.
14. Галлингер Ю.И., Годжелло Э.А. Оперативная эндоскопия пищевода. М.: Медицина, 1999. Gallinger YuI, Godzhello EA. Operativnaya endoskopiya pishchevo- da. M.: Meditsina, 1999. (In Russ.).
15. Черноусов А.Ф., Шестаков А.Л., Тамазян Г.С. Рефлюкс-эзофагит. М.: Медиа Сфера, 1999. Chernousov AF, Shestakov AL, Tamazyan GS. Reflyuks-ezofagit. M.: Media Sfera, 1999. (In Russ.).
Поступила 08.09.19 Received 08.09.19 Принята к печати 28.09.19 Accepted 28.09.19
ДОКАЗАТЕЛЬНАЯ ГАСТРОЭНТЕРОЛОГИЯ, 2019, Т. 8, № 3
Оставить отзыв



